科研进展
兰州化物所高效靶向智能响应抗肿瘤药物递送获新进展
高效精准药物递送是新药研发和精准医疗的关键。然而,现有的药物递送策略在提高肿瘤治疗效果和改善预后方面仍面临巨大挑战,主要受限于靶向性、精准释放以及肿瘤免疫抑制微环境等因素。
近日,中国科学院兰州化学物理研究所天然药物与化学测量研究中心海军人才团队与新疆大学合作,针对传统抗肿瘤药物递送系统的局限性,发展了一种“高效靶向+刺激响应+光热协同”智能响应抗肿瘤药物递送材料。研究人员通过将一氧化氮供体L-精氨酸(L-Arg)负载到具有近红外吸收的中空硫化铜纳米颗粒(HCuSNPs)中,并与肿瘤靶向肽(RGD)组装,合成AHPR智能纳米递送材料。体外和体内实验表明,近红外光激发下AHPR产生热效应,诱导纳米结构降解并释放铜离子和一氧化氮,提高血管通透性,促进药物深度渗透。同时,协同触发光热治疗、铜死亡及活性氧/活性氮风暴,实现高效抗肿瘤效果(体积减少90%)。
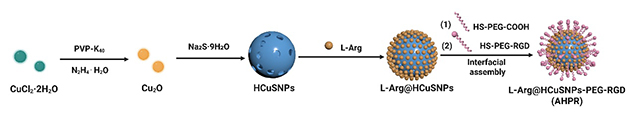
图1. 智能响应抗肿瘤药物递送材料设计与制备
研究人员进一步利用荧光-光声成像可视化技术,揭示了智能响应抗肿瘤药物递送体系的作用机制。结果表明,AHPR组装肿瘤靶向肽,可主动识别并富集于肿瘤部位,实现高效靶向递送。并在近红外光激发下,通过温和光热、铜死亡和ONOO‑产生等机制调控肿瘤免疫微环境,促进DCs成熟,增强T细胞的浸润和巨噬细胞极化,诱导免疫原性细胞死亡,将“冷”肿瘤转化为“热”肿瘤。值得注意的是,AHPR可与免疫检查点抑制剂(αPD-L1) 结合,进一步增强免疫应答率,改善肿瘤治疗效果。这一策略为抗肿瘤药物智能递送材料开发和多维肿瘤免疫治疗提供了新思路。
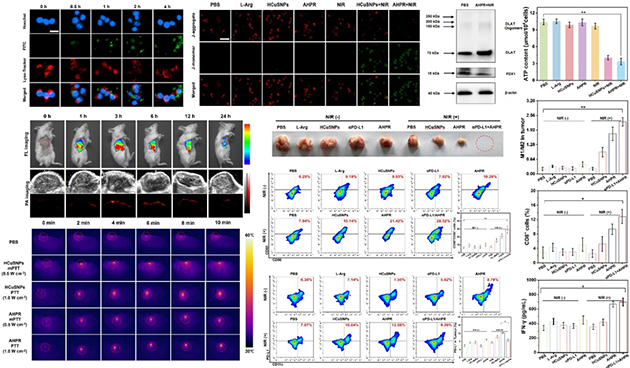
图2. 智能响应抗肿瘤药物递送材料活性评价
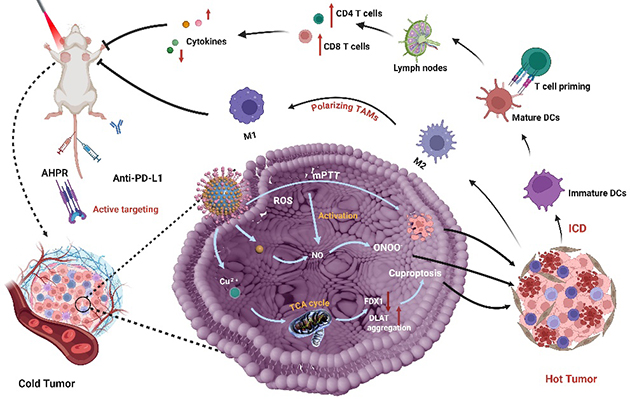
图3. 智能响应抗肿瘤药物递送材料作用机制
相关研究成果以“Copper-based hollow mesoporous nanogenerator with reactive oxygen species and reactive nitrogen species storm generation for self-augmented immunogenic cell death-mediated triple-negative breast cancer immunotherapy”为题发表在Journal of Colloid And Interface Science(2025,688,688-702)上。景泉博士为论文第一作者,邸多隆研究员和海军研究员为论文共同通讯作者。
以上工作得到了国家自然科学基金、甘肃省自然科学基金、甘肃省科技计划等项目的支持。








